.
NPM 2013023034
Izin bertanya kepada kelompok 11
Pada diagram Frost dijelaskan bahwa semakin rendah nilai NE^0 maka spesi akan lebih stabil. Mengapa demikian?
NPM : 2013023002
Kelompok : 11
Izin menjawab pertanyaan dari zilal, NE° yang semakin rendah maka spesinya akan lebih stabil, karena semakin kecil nilai NE° maka akan semakin mudah dalam pembentukan standar nya, sehingga semakin rendah NE° maka akan lebih stabil.
Npm : 2013023018
Izin bertanya kepada kelompok 11
Tadi dividio disebutkan bahwa ada pengikat dan pelepasan oksigen, tadi juga sempat disinggung mengenai contoh dari pengikat oksigen akan tetapi dari pelepasan oksigennya belum. Pertanyaan saya sebutkan dan jelaskan apa saja contoh dari pelepasan oksigen yang terjadi dalam kehidupan sehari-hari?
NPM : 2013023048
Kelompok : 11
Izin menjawab pertanyaan dari Asni
Contoh dari pelepasan oksigen dalam kehidupan sehari-hari adalah :
1. Ekstraksi Bijih Besi
Dalam estraksi tersebut oksida besi (bijih besi) mengalami direduksi untuk menghilangkan oksigen di dalamnya. Hal tersebut dilakukan untuk mendapatkan besi murni (Fe) dengan bantuan karbon monoksida (CO) sebagai agen pereduksinya.
2.Reaksi pemurnian tembaga
Reaksi pemurnian tembaga menggunakan sel volta. Di mana ion Cu2+ akan mengalami reaksi reduksi dengan agen pereduksi berupa magnesium sehingga menghasilkan endapan tembaga murni (Cu). Dari reaksi terlihat bahwa Cu mengalami kenaikan 2 elektron sehingga muatannya menjadi netral.
3.Reaksi antara logam seng dan asam klorida
Logam seng (Zn) saat direaksikan dengan asam klorida (HCl) akan melepaskan elektron. Elektron kemudian akan diterima oleh hidrogen, sehingga seng mengalami reduksi sedangkan hidrogen mengalami oksidasi.
4. Fotosintesis
Reaksi fotosintesis adalah contoh dari reaksi reduksi dimana senyawa karbon dioksida mengalami reduksi karena melepaskan oksigen.
npm : 2013023038
Izin bertanya,
Berdasarkan pemaparan yang telah dijelaskan dalam video apa yang dapat kalian simpulkan dari bilangan oksidasi?
NPM : 2013023006
Izin bertanya,
Dalam presentasi anda dikatakan “Apabila dalam suatu ikatan atom unsur memiliki harga elektronegatifitas sama, disepakati memiliki harga biloks nol, apabila atom unsur memiliki harga elektronegatifitas besar memiliki harga biloks negatif, dan jika elektronegatifitas nya kecil memiliki harga biloks positif”
Adakah contoh bilangan oksidasi unsur yang bisa anda berikan untuk menerangkan pernyataan tersebut?
NPM : 2013023002
KELOMPOK : 11
Izin menjawab, contohnya adalah Cl yang memiliki keelektronegatifan yang tinggi, maka dari kesepakatannya yaitu unsur yang memiliki harga elektronegativitas yang tinggi sama bilangan oksidasinya bernilai negatif, sehingga Cl memiliki bilangan oksidasi Cl-, sementara untuk Na memiliki elektronegatif yang rendah sehingga bilangan oksidasi dari Na adalah positif.
NPM : 2013023022
Izin bertanya, pada sel volta ada medium penghantar yaitu jembatan garam, apa fungsi jembatan garam? Dan bagaimana jika pada sel volta tidak terdapat jembatan garam?
NPM : 2013023002
Izin menjawab, Fungsi jembatan garam adalah untuk menjadikan reaksi dalam sel volta terus berlanjut. Tanpa jembatan garam yang menghubungkan kedua larutan, terjadinya penumpukan muatan positif dalam kompartemen anoda (karena pembentukan ion Zn2+) dan muatan negatif dalam kompartemen katoda (terjadi ketika sebagian ion Cu2+ tereduksi menjadi Cu) tentunya dengan cepat akan menghentikan kerja sel. Dengan kata lain, tanpa jembatan garam reaksi berlangsung hanya sesaat sebag kelebihan ion-ion hasil reaksi redoks tidak ada yang menetralkan dan akhirnya reaksi berhenti seketika.
NPM : 2013023048
Izin menjawab pertanyaan dari Nurul
Fungsi jembatan garam adalah untuk menjadikan reaksi dalam sel volta terus berlanjut. Tanpa
jembatan
garam
yang menghubungkan kedua
larutan, terjadinya penumpukan muatan positif dalam kompartemen anoda (karena
pembentukan ion Zn2+) dan muatan negatif dalam kompartemen katoda (terjadi ketika sebagian ion Cu2+ tereduksi menjadi Cu) tentunya dengan cepat akan menghentikan
kerja sel. Dengan kata lain, tanpa jembatan garam reaksi berlangsung hanya sesaat
sebab kelebihan ion-ion hasil reaksi redoks tidak ada yang menetralkan dan akhirnya
reaksi berhenti seketika.
NPM : 2013023016
Izin bertanya kepada kelompok 11,
bagaimana cara melihat kestabilan pada diagram frost?
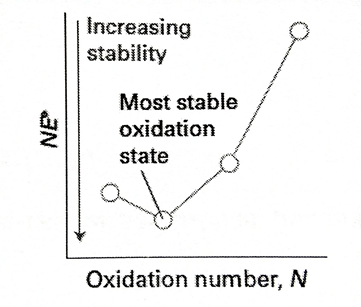
Apabila zat membentuk kurva cekung seperti gambar diatas, maka zat tersebut dikatakan stabil. dikarenakan apabila semakin rendah grafik sebuah zat, maka akan semakin rendah nilai NE°, semakin rendah nilai NE°, maka semakin stabil zat tersebut.
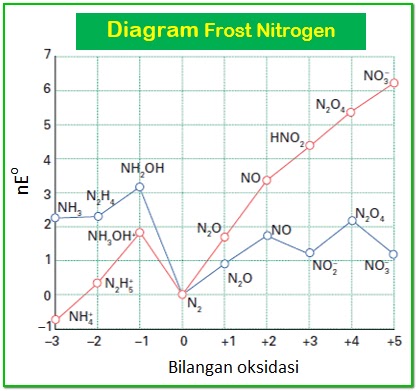
sebagai contoh, coba perhatikan diagram frost diatas, untuk grafik yang berwarna merah, maka zat/spesi yang paling stabil adalah NH4, dikarenakan grafik NH4, adalah yang paling rendah, dan menunjukkan nilai NE° yang paling rendah yaitu -1. sedangkan untuk grafik yang berwarna biru, spesi/zat yang paling stabil adalah N2, dikarenakan grafik N2, yang paling rendah, dan menunjukkan nilai NE° yang paling rendah, yaitu 0.
NPM : 2013023014
Izin bertanya
Apakah alasan berkembangnya konsep reaksi redoks dari penglepasan dan penangkapan elektron ke konsep perkembangan redoks yang berkaitan dengan kenaikan dan penurunan bilangan oksidasi?
izin menjawab, Karena konsep reaksi redoks berdasarkan penglepasan dan penangkapan elektron sulit dijelaskan pada senyawa kovalen, sehingga untuk menjelaskan reaksi redoks pada senyawa kovalen digunakan konsep redoks kenaikan dan penurunan bilangan oksidasi.
NPM: 2013023058
Izin bertanya, Dalam video dan makalah disebutkan tentang dan reaksi disproporsionasi dan reaksi konproporsionasi, coba jelaskan apa reaksi disproporsionasi dan reaksi konproporsionasi dan bagaimana contohnya
NPM : 2013023002
Izin menjawab, Reaksi autoredoks atau disproporsionasi adalah reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama. Jadi, sebagian dari zat itu mengalami oksidasi dan sebagian lagi mengalami reduksi.
Contoh :
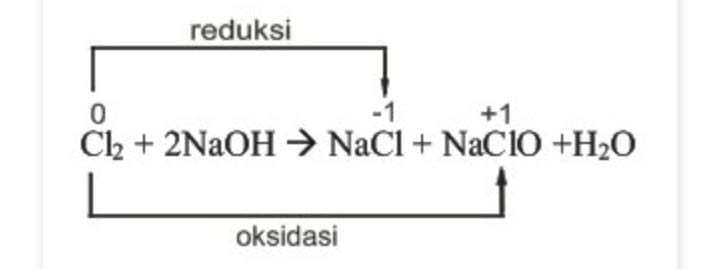
Sebagian dari gas klorin (Cl2) (biloks = 0) mengalami reduksi menjadi NaCl (biloks = -1) dan sebagian lagi mengalami oksidasi menjadi NaClO ( biloks = +1).
Reaksi konproporsionasi merupakan kebalikan dari reaksi disproporsionasi, yaitu reaksi redoks dimana hasil reduksi dan oksidasinya sama.
Contoh :
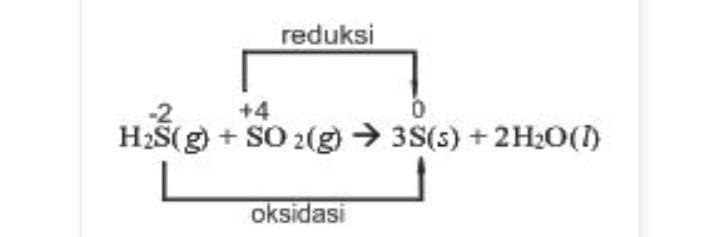
Pada reaksi tersebut hasil reduksi dan oksidasinya merupakan zat yang sama, yaitu belerang (S).
Npm : 2013023050
Izin bertanya, tadi diawal video diberikan fenomena mengenai perkataan besi. Pertanyaan saya apa hubungannya reaksi redoks pada perkaratan besi dan bagaimana reaksi yang terjadi pada besi tersebut?
NPM : 2013023002
izin menjawab, Hubungan redoks dgn pengkaratan besi yaitu, pada besi terdapat elektrode yg berperan sebgai anode dan katode. besi mengalami oksidasi sedangkan oksigen mengalami reduksi. pada saat besi mengalami oksidasi, elektron dari anode akan mengalir ke katode, di mana oksigen tereduksi. selanjutnya ion besi (II) yg terbentuk pada anode teroksidasi membentuk ion besi (III) yang kemudian membentuk senyawa oksida terhidrasi, Fe2O3.xH2O (karat besi).
Dan reaksi yg terjadi
anode (oksidasi)
Fe(s) ----> Fe2+(aq) + 2e
katode (reduksi)
O2 (g) +2H2O(l) + 4e ----> 4OH- (aq) atau
O2 (g) + 4H+ (aq) + 4e ---->2H2O (l)
NPM : 2013023024
Izin bertanya di makalah disebutkan bahwa elektroda yang umumnya digunakan adalah elektroda inert, pertanyaan nya bagaimana jika elektroda tak inert yang digunakan?
Jika elektroda yang digunakan adalah elektroda non inert (selain C, Pt, Au), maka elektroda tersebut akan teroksidasi menjadi ion-ion logamnya.
Npm : 2013023030
Izin Bertanya
Pada presentasi yang telah di jelaskan bahwa Untuk membandingkan kecenderungan suatu logam mengalami oksidasi atau reduksi tidak bisa diukur secara langsung namun digunakan elektroda pembanding, yaitu elektroda hidrogen.Apakah yang di maksud dari elektroda Hidrogen tersebut?
Elektroda hidrogen standar adalah ukuran standar potensial elektroda untuk skala termodinamika potensial redoks. Elektroda hidrogen standar sering disingkat sebagai SHE atau dapat dikenal sebagai elektroda hidrogen normal (NHE). Secara teknis, SHE dan NHE berbeda. NHE mengukur potensi elektroda platinum dalam larutan asam 1 N, sementara SHE mengukur potensi elektroda platinum dalam solusi ideal (standar nol potensial saat ini di semua suhu).
NPM: 2013023064
Izin bertanya,
Bagaimanakah pengaplikasian sel elektrolisis dalam kehidupan sehari-hari?
NPM : 2013023048
Kelompok : 11
Izin menjawab pertanyaan dari Apriza pengaplikasian sel elektrolisis dalam kehidupan sehari-hari seperti :
1. Cara kerja sel elektrolisis digunakan untuk metode pembuatan gas oksigen hidrogen atau gas klorin di laboratorium.
2. Digunakan pada proses penyembuhan logam menggunakan logam mulia seperti emas perak atau nikel.
3. dimanfaatkan untuk proses pemurnian logam kotor logam kata diletakkan diantara sedangkan logam murni ditempatkan di katoda.
npm 2053023003
izin bertanya kepada kelompok 11, bagaimana hubungan elektronegativitas dengan bilangan oksidasi
NPM : 2013023048
Kelompok : 11
Izin menjawab pertanyaan dari Fasya
Hubungan elektronegativitas dengan bilangan oksidasi adalah Tingkat oksidasi atau bilangan oksidasi (biloks) dinyatakan sebagai derajat terhadap harga elektronegativitasnya.
Angka oksidasi mencerminkan muatan hipotesis atom dalam senyawa. Sementara ion memiliki muatan listrik aktual, atom molekuler tidak perlu memiliki muatan. Namun, mereka dapat menarik elektron dalam molekul dengan cara yang tidak seimbang. Bilangan oksidasi mencerminkan kecenderungan ini, dan elektronegativitas membantu menentukan atom mana yang menarik elektron dalam molekul.
Npm: 2013023020
Izin bertanya kepada kelompok 11, kan sudah di jelaskan tentang Materi reaksi redoks. Nah yang ingin saya tanyakan keuntungan dan kerugian dari reaksi redoks tersebut?
Reaksi redoks memiliki banyak manfaat dalam kehidupan sehari-hari dilihat dari aplikasi penerapannya. Diantaranya seperti di bawah ini :
1.Reaksi Redoks Pada Pengolahan Logam
2.Reaksi Redoks Pada Penyambungan Besi
3 Reaksi Redoks Pada Sel Aki
4. Proses fotosintesis
5. Pembakaran
6. Zat pemutih
Kerugian Reaksi Redoks
Reaksi Redoks yang merugikan dalam kehidupan sehari-hari antara lain adalah korosi. Korosi adalah kerusakan atau degradasi logam akibat reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa sehari-hari, korosi disebut perkaratan. Contoh korosi yang paling lazim adalah perkaratan besi.
Npm: 2013023040
Izin bertanya,
Dalam video telah dijelaskan mengenai sel volta, Pertanyaan saya adalah bagaimana prinsip dari sel volta?
Terimakasih
NPM : 2013023048
Izin menjawab pertanyaan dari Siti Nurani
Sel volta melibatkan reaksi redoks dan menghasilkan arus listrik. Sel volta selalu terbentuk dari dua elektroda dengan Eº yang berbeda. Elektroda dengan Eº lebih negative mengalami oksidasi dan bertindak sebagai anoda (kutup negative). Sedangkan Elektroda dengan Eºlebih positif mengalami reduksi dan bertindak sebagai katoda (kutup positif). Dan arah aliran elektron dari anoda ke katoda. Jembatan garam mengandung ion-ion positif dan ion-ion negative yang berfungsi menetralkan muatan positif dan negative dalam larutan elektrolit.
NPM : 2013023052
Izin bertanya, Bagaimana perbedaan diagram Latimer dan diagram Frost dalam memprediksi reaksi redoks?
Diagram Latimer adalah potensial reduksi standar untuk satu set spesies yang saling berhubungan dapat ditampilkan dalam bentuk diagram potensial reduksi.
Diagram Frost adalah jenis grafik yang digunakan oleh ahli kimia anorganik dalam elektrokimia untuk menggambarkan stabilitas relatif dari sejumlah berbeda oksidasi dari zat tertentu.
Npm : 2013023010
Izin bertanya,
Dalam penjelasan diagram Pourbaix yang kalian sampaikan, saya masih belum seberapa paham tentang apa itu diagram Pourbaix, dan bisa tolong kalian jelaskan bagaimana kegunaan dari diagram ini?
NPM : 2013023002
Izin menjawab, Diagram Pourbaix adalah diagram yang menggambarkan keadaan suatu bahan dengan potensial tertentu dalam derajat keasaman (pH) tertentu. Sumbu vertikal pada diagram menunjukkan potensial zat, sedangkan sumbu horizontal menunjukkan pH zat.
Kegunaan utama diagram Pourbaix terutama adalah untuk memperkirakan arah reaksi spontan, komposisi produk korosi dan perubahan lingkungan yang akan mencegah atau menurunkan laju serangan korosi.
NPM : 2013023054
Dalam video dijelaskan bahwa apel mengalami perubahan warna dan rasa termasuk reaksi REDOKS, pertanyaan saya adalah apakah perubahan bau dan rasa pada minyak goreng menjadi tengik terjadi karna reaksi REDOKS ? jika iya, bagaimana prosesnya ?
NPM : 2013023002
Izin menjawab, Kerusakan lemak yang utama adalah timbulnya bau dan rasa tengik yang disebut proses ketengikan (rancidity). Berbagai jenis minyak atau lemak akan mengalami perubahan flavor dan bau sebelum terjadi proses ketengikan. Bilangan peroksida yang sangat tinggi dapat menjadi indikasi ketengikan minyak atau lemak (Ketaren, 2008). Ketengikan terjadi karena asam lemak pada suhu ruang dirombak akibat hidrolisis atau oksidasi menjadi hidrokarbon, alkanal, atau keton, serta sedikit epoksi dan alcohol (alkanol). Bau yang kurang sedap muncul akibat campuran dari berbagai produk ini. Selain pada suhu kamar, proses ini dapat terjadi selama proses pengolahan menggunakan suhu tinggi. salah satu penyebab perubahan bau dan rasa menjadi tengik adalah reaksi oksidasi
Ketengikan oleh oksidasi (oxidative rancidity) Ketengikan ini terjadi karena proses oksidasi oleh oksigen udara terhadap asam lemak tidak jenuh dalam minyak. Proses oksisidasi dapat terjadi pada suhu kamar, dan selama proses pengolahan menggunakan suhu tinggi. Penyebab utama oksidasi lemak adalah autooksida. Reaksi autooksidasi pada lemak terjadi melalui pembentukan radikal bebas. Terdapat tiga tahap yaitu inisiasi, propagasi, dan terminasi. Pada tahap inisiasi, terjadi pembentukan radikal dari molekul lipida atau trigliserida. Asam lemak tak jenuh yang terdapat pada minyak memiliki ikatan rangkap, sehingga terdapat atom H yang tidak stabil pada rantai lemak. Akibat adanya pemanasan, atom H dapat lepas dari ikatannya.
NPM : 2013023004
Izin bertanya, apakah artinya bila potensial reduksi suatu elektroda bernilai negatif dan apakah artinya bila potensial reduksi suatu elektroda bernilai positif?
NPM : 2013023048
Izin menjawab
Elektrode yang digunakan terdapat 2 jenis yaitu elektrode bermuatan positif (+) yang menandakan bahwa elektrode tersebut merupakan elektrode tempat terjadinya Reduksi, sebaliknya elektrode bermuatan negatif (-) yang menandakan bahwa elektroda tersebut merupakan elektroda tempat terjadinya Oksidasi.
Nama : Rizka Awalia Rodhiah
Npm : 2013023060
Izin bertanya.
Mengapa ikatan atom unsur memiliki harga elektronegativitas yang sama itu disepakati memiliki harga biloks nol?
NPM : 2013023048
Izin menjawab karena Tingkat oksidasi atau bilangan oksidasi (biloks) dinyatakan sebagai derajat terhadap harga elektronegativitasnya. apabila dalam suatu ikatan atom unsur memiliki harga elektronegativitas sama disepakati memiliki harga biloks Nol.
Karena hal ini sesuai dengan aturan biloks : Jumlah biloks unsur-unsur pembentuk senyawa netral sama dengan nol.
Bilangan oksidasi adalah banyaknya elektron yang dilepas atau diterima dalam pembentukan suatu molekul atau ion. Nilai biloks dapat bernilai positif atau negatif, bilangan oksidasi disingkat dengan biloks. Beberapa atom hanya memiliki satu biloks, ada juga yang memiliki lebih dari satu biloks.
Tanda (+) dan (-) pada biloks ditulis sebelum angkanya, misalnya +2, atau +1; sedangkan pada muatan ditulis sesudah angkanya, misal, 2+ atau 3+.
Npm : 2013023012
Izin bertanya, apakah contoh kegunaan reaksi redoks dalam kehidupan sehari hari?
1. Pada metode lumpur aktif terjadi reaksi oksidasi untuk pertumbuhan bakteri aerob dan terjadi reaksi reduksi pada substrat atau buangan.
2. Pada berbagai bidang industri digunakan sebagai pelapisan dan pengolahan logam.
3. Reaksi redoks juga digunakan dalam aki dan baterai sebagai sumber energi listrik.
4. Konsep reaksi redoks juga diterapkan dalam proses penyepuhan emas.
Npm : 2013023028
Izin bertanya , pada elektrolisis kation-kation logam apa saja yang dapat dan tidak dapat direduksi di katode?
→ Kation logam yang dapat direduksi : Kation logam Sn, Pb, Bi dan logam golongan transisi seperti Cr, Ni, Co, Cu, Ag, Hg dan banyak lagi.
NPM : 2013023042
izin bertanya, Apa saja contoh penerapan sel volta dalam kehidupan sehari hari?
izin menjawab, contoh penerapan sel volta dalam kehidupan sehari hari, yaitu:
1. Aki atau accumulator merupakan sel volta yang tersusun atas elektroda Pb dan PbO
2. Penerapan Sel Volta Pada Baterai
Baterai atau sel kering merupakan salah satu sel volta, yaitu sel yang menghasilkan arus listrik, berbeda dengan aki, batere tidak dapat diisi kembali.Batere disusun oleh Seng sebagai anoda, dan grafit dalam elektrolit MnO2, NH4Cl dan air bertindak sebagai katoda
NPM : 2013023044
Izin bertanya,
Pada jembatan garam bahan apakah yang digunakan untuk menyumbat ujung-ujung pipa?
terimakasih
NPM : 2013023048
Izin menjawab
Untuk mengatasi penumpukan muatan di kedua setengah sel, daapat digunakan suatu rangkaian dalam yang disebut jembatan garam. Jembatan garam biasanya berupa pipa kaca yang berbentuk U. Kedua ujung pipa ditutup dengan busa penyumbat. Di dalamnya berisi agar-agar yang mengandung garam seperti NaCl, KCl, dan K2SO4. Jembatan garam pada rangkaian sel volta memungkinkan ion-ion mengalir dari setengah sel anoda ke setengah sel katoda, dan sebaliknya, tetapi mencegah bercampurnya kedua elektrolit secara berlebih.
