.
Nama : Nurul Hidayah
NPM : 2013023022
Izin bertanya, mengapa tidak ada senyawa ionik yang karakter ioniknya 100%?
Terima kasih
NPM : 2013023022
Izin bertanya, mengapa tidak ada senyawa ionik yang karakter ioniknya 100%?
Terima kasih
Muhammad Fasya wiranata
npm 2053023003
izin menjawab pertanyaan nurul
karena menurut pauling untuk senyawa biner yang tersusun atas atom A dan B dengan keelektronegatifan atom B lebih besar dari A, maka karakter ioniknya dapat diperkirakan dengan persamaan berikut:
Karakter ionik = 1-e^1/4(XB-XA)
XA= keelektronegatifan atom A
XB = Keelektronegatifan atom B
Suatu senyawa biner yang presentasi karakter ioniknya lebih dari 50% dapat dianggap sebagai senyawa ionik. bila karakter ionik nya kurang dari 50% dapat dianggap sebagai senyawa kovalen polar.
npm 2053023003
izin menjawab pertanyaan nurul
karena menurut pauling untuk senyawa biner yang tersusun atas atom A dan B dengan keelektronegatifan atom B lebih besar dari A, maka karakter ioniknya dapat diperkirakan dengan persamaan berikut:
Karakter ionik = 1-e^1/4(XB-XA)
XA= keelektronegatifan atom A
XB = Keelektronegatifan atom B
Suatu senyawa biner yang presentasi karakter ioniknya lebih dari 50% dapat dianggap sebagai senyawa ionik. bila karakter ionik nya kurang dari 50% dapat dianggap sebagai senyawa kovalen polar.
Baik Fasya terima kasih atas jawabannya
Nama : Anfasa Rizga Aprilia
NPM : 2013023006
Kelompok 3
Pada video anda, dijelaskan bahwa pelarut polar umumnya mempunyai tetapan dielektrikum tinggi.
Mohon maaf sebelumnya, kata "Tetapan dielektrikum" masih asing ditelinga saya, apakah anda sekalian bisa menjelaskan apa itu yang dimaksud tetapan dielektrikum?
NPM : 2013023006
Kelompok 3
Pada video anda, dijelaskan bahwa pelarut polar umumnya mempunyai tetapan dielektrikum tinggi.
Mohon maaf sebelumnya, kata "Tetapan dielektrikum" masih asing ditelinga saya, apakah anda sekalian bisa menjelaskan apa itu yang dimaksud tetapan dielektrikum?
Muhammad Fasya Wiranata
npm 2053023003
Konstanta dielektrik atau permitivitas listrik relatif, adalah suatu konstanta dalam pengetahuan fisika. Konstanta ini melambangkan rapatnya fluks elektrostatik dalam suatu bahan bila diberi potensial listrik. Konstanta dielektrik adalah perbandingan energi listrik yang tersimpan pada bahan tersebut jika diberi suatu potensial, relatif terhadap vakum (ruang hampa).
npm 2053023003
Konstanta dielektrik atau permitivitas listrik relatif, adalah suatu konstanta dalam pengetahuan fisika. Konstanta ini melambangkan rapatnya fluks elektrostatik dalam suatu bahan bila diberi potensial listrik. Konstanta dielektrik adalah perbandingan energi listrik yang tersimpan pada bahan tersebut jika diberi suatu potensial, relatif terhadap vakum (ruang hampa).
Nama : Asni Rahma Tika
Npm : 2013023018
Izin bertanya kepada kelompok 10
Tadikan dividio dijelaskan bahwa contoh NaCl menjadi memendek separuhnya, saya belum paham mengapa hal tersebut bisa terjadi?
Npm : 2013023018
Izin bertanya kepada kelompok 10
Tadikan dividio dijelaskan bahwa contoh NaCl menjadi memendek separuhnya, saya belum paham mengapa hal tersebut bisa terjadi?
karena ada nya gaya yang cukup untuk menggeser sedikit ion-ion sehingga panjang ikatan menjadi memendek separohnya maka gaya yang semula tarik-menarik akan berubah menjadi gaya tolak-menolak karena kontak antar anion dan antar kation menjadi lebih signifikan. Akibtanya, kristal menjadi mudah terpecah-belah, berikut saya lampirkan gambar nya
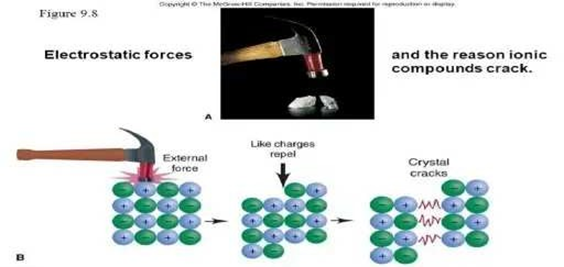
NAMA : EMILIA NAFAZA
NPM : 2013023002
Izin bertanya, pada bagian kisi kristal dijelaskan bahwa struktur CaF2 memiliki rasio stoikiometri katian/anion 1:2 sementara pada struktur TiO2 juga memiliki rasio stoikiometri katian/anion 1:2, pertanyaan saya, apa yang membuat kedunya dikelompokan berbeda sementara mempunyari rasio stoikiometri kation/anion yang sama?
NPM : 2013023002
Izin bertanya, pada bagian kisi kristal dijelaskan bahwa struktur CaF2 memiliki rasio stoikiometri katian/anion 1:2 sementara pada struktur TiO2 juga memiliki rasio stoikiometri katian/anion 1:2, pertanyaan saya, apa yang membuat kedunya dikelompokan berbeda sementara mempunyari rasio stoikiometri kation/anion yang sama?
Muhammad Fasya Wiranata
npm 2053023003
izin menjawab , Pada kisi kristal CaF2 setiap ion Ca dikelilingi oleh 8 ion F– dengan geometri kubus sederhana. Sedangkan setiap ion F– dikelilingi oleh 4 ion Ca2+ dengan geometri tetrahedral. Dengan demikian bilangan koordinasi ion Ca2+ adalah 8, sedangkan bilangan koordinasi ion F– adalah 4. Sementara pada TiO2 adalah senyawa ionik yang dibentuk dari ion-ion Ti4+ dan ion O2-. Kisi kristal rutil adalah trigonal primitif, sehingga kdeunua dikelompokan berbeda dimana CaF2 fluorit dan TiO2 rutil.
npm 2053023003
izin menjawab , Pada kisi kristal CaF2 setiap ion Ca dikelilingi oleh 8 ion F– dengan geometri kubus sederhana. Sedangkan setiap ion F– dikelilingi oleh 4 ion Ca2+ dengan geometri tetrahedral. Dengan demikian bilangan koordinasi ion Ca2+ adalah 8, sedangkan bilangan koordinasi ion F– adalah 4. Sementara pada TiO2 adalah senyawa ionik yang dibentuk dari ion-ion Ti4+ dan ion O2-. Kisi kristal rutil adalah trigonal primitif, sehingga kdeunua dikelompokan berbeda dimana CaF2 fluorit dan TiO2 rutil.
Nama: Anisa Auliya Sapitri
Npm: 2013023020
Izin bertanya pada Kelompok 10, kan sudah di jelaskan tentang senyawa ionik dan senyawa kovalen. Nah yang saya ingin tanyakan apa perbedaan dari senyawa ionik dan senyawa kovalen tersebut?
Npm: 2013023020
Izin bertanya pada Kelompok 10, kan sudah di jelaskan tentang senyawa ionik dan senyawa kovalen. Nah yang saya ingin tanyakan apa perbedaan dari senyawa ionik dan senyawa kovalen tersebut?
In reply to Anisa Auliya Sapitri 2013023020
Re: Padatan ionik
Muhammad Fasya Wiranata
npm 2053023003
izin menjawab
Senyawa ionik adalah senyawa yang terbentuk karena adanya ikatan ion, yaitu tarik-menarik elektrostatik antara ion positif yang disebut dengan kation dengan ion negatif (anion). Biasanya senyawa ini dibentuk oleh unsur-unsur logam dengan nonlogam. Sementara senyawa kovalen terbentuk karena adanya ikatan kovalen yang terjadi karena pemakaian bersama pasangan elektron. Biasanya terjadi pada unsur-unsur nonlogam. Jika memperhatikan sifat fisik kedua senyawa ini, perbedaannya adalah sebagai berikut:
1. Pada suhu ruang senyawa ionik berwujud padat berbentuk kristal, sedangkan senyawa kovalen ada yang berwujud gas, cair, maupun padat.
2.Titik didih dan titik leleh senyawa ion lebih tinggi dibandingkan senyawa kovalen.
3. Senyawa ionik hanya larut dalam pelarut polar (misalnya air), sedangkan senyawa kovalen ada yang larut dalam pelarut polar dan ada juga yang larut dalam pelarut nonpolar.
4. Senyawa ionik dalam wujud cair dan larutan dapat menghantarkan listrik, sedangkan senyawa kovalen (polar) dapat menghantarkan listik jika dalam bentuk larutan.
Jadi, perbedaan senyawa ionik terbentuk dari ikatan ion yang biasanya terjadi antara unsur logam dengan non logam, sementara senyawa kovalen terbentuk dari ikatan kovalen yang biasanya terjadi antara sesama unsur nonlogam
npm 2053023003
izin menjawab
Senyawa ionik adalah senyawa yang terbentuk karena adanya ikatan ion, yaitu tarik-menarik elektrostatik antara ion positif yang disebut dengan kation dengan ion negatif (anion). Biasanya senyawa ini dibentuk oleh unsur-unsur logam dengan nonlogam. Sementara senyawa kovalen terbentuk karena adanya ikatan kovalen yang terjadi karena pemakaian bersama pasangan elektron. Biasanya terjadi pada unsur-unsur nonlogam. Jika memperhatikan sifat fisik kedua senyawa ini, perbedaannya adalah sebagai berikut:
1. Pada suhu ruang senyawa ionik berwujud padat berbentuk kristal, sedangkan senyawa kovalen ada yang berwujud gas, cair, maupun padat.
2.Titik didih dan titik leleh senyawa ion lebih tinggi dibandingkan senyawa kovalen.
3. Senyawa ionik hanya larut dalam pelarut polar (misalnya air), sedangkan senyawa kovalen ada yang larut dalam pelarut polar dan ada juga yang larut dalam pelarut nonpolar.
4. Senyawa ionik dalam wujud cair dan larutan dapat menghantarkan listrik, sedangkan senyawa kovalen (polar) dapat menghantarkan listik jika dalam bentuk larutan.
Jadi, perbedaan senyawa ionik terbentuk dari ikatan ion yang biasanya terjadi antara unsur logam dengan non logam, sementara senyawa kovalen terbentuk dari ikatan kovalen yang biasanya terjadi antara sesama unsur nonlogam
Nama : Zhilal Zhafirah
NPM 2013023034
Izin bertanya
didalam video tadi dijelaskan oleh Rafino bahwasannya "biasanya, anion-anion yang umumnya lebih besar ukurannya membentuk kemas-rapat, dan kation yang
lebih kecil ukurannya menempati rongga yaitu rongga tetrahedral dan atau rongga oktahedral. Tetapi dalam beberapa kasus situasi ini dapat terbalik."
Maksud dari beberapa kasus situasi ini dapet terbalik itu bagaimana ya kemudian contohnya seperti apa?
Terima kasih
NPM 2013023034
Izin bertanya
didalam video tadi dijelaskan oleh Rafino bahwasannya "biasanya, anion-anion yang umumnya lebih besar ukurannya membentuk kemas-rapat, dan kation yang
lebih kecil ukurannya menempati rongga yaitu rongga tetrahedral dan atau rongga oktahedral. Tetapi dalam beberapa kasus situasi ini dapat terbalik."
Maksud dari beberapa kasus situasi ini dapet terbalik itu bagaimana ya kemudian contohnya seperti apa?
Terima kasih
Maksud dari "situasi ini dapat terbalik" adalah di beberapa kasus anion bisa saja memiliki ukuran yang lebih kecil sehingga menempati rongga (tethrahedron atau oktahedron). Contohnya dapat dilihat pada struktur sesium klorida (CsCl). Ukuran Cs+ relatif lebih besar sehingga memerlukan rongga yang lebih besar daripada oktahedron. Hal itu lah yang menyebabkan struktur sesium klorida (CsCl) mengkristal dalam bentuk kubus sederhana sehingga bukan termasuk struktur kemas-rapat.
Nama : Justine
NPM : 2013023024
Izin bertanya
Mengapa senyawa kristal yang memiliki ikatan ionik memiliki sifat sangat keras tetapi rapuh?
NPM : 2013023024
Izin bertanya
Mengapa senyawa kristal yang memiliki ikatan ionik memiliki sifat sangat keras tetapi rapuh?
Nama : Upit Nurjanah
NPM : 2013023050
izin menjawab, senyawa kristal yang memiliki ikatan ionik memiliki sifat sangat keras tetapi rapuh. Hal ini dikarenakan ikatan antara ion positif dengan ion negatif sangat kuat sehingga untuk memisahkan ion-ion memerlukan energi yang besar. Senyawa ion dapat mudah larut dalam air membentuk ion-ionnya. Tolak-menolak elektrostatik dapat untuk membagi kristal, sehingga padatan ionik bersifat rapuh.
NPM : 2013023050
izin menjawab, senyawa kristal yang memiliki ikatan ionik memiliki sifat sangat keras tetapi rapuh. Hal ini dikarenakan ikatan antara ion positif dengan ion negatif sangat kuat sehingga untuk memisahkan ion-ion memerlukan energi yang besar. Senyawa ion dapat mudah larut dalam air membentuk ion-ionnya. Tolak-menolak elektrostatik dapat untuk membagi kristal, sehingga padatan ionik bersifat rapuh.
NAMA : EMILIA NAFAZA
NPM : 2013023002
izin menambahkan, Ikatan ion rapuh dikarenakan lapisan-lapisan dapat bergeser jika dikenakan gaya luar catatan, akibat pergeseran, maka akan terjadi ion sejenis yang dapat berada satu diatas yang lainnya, sehingga menimbulkan tolak menolak yang sangat kuat kemudian menyebapkan pemisahan atau rapuh sementara untuk ikatan ion bersifat keras karena ion-ion positif dan negative terikat kuat oleh gaya elektrostatik.
NPM : 2013023002
izin menambahkan, Ikatan ion rapuh dikarenakan lapisan-lapisan dapat bergeser jika dikenakan gaya luar catatan, akibat pergeseran, maka akan terjadi ion sejenis yang dapat berada satu diatas yang lainnya, sehingga menimbulkan tolak menolak yang sangat kuat kemudian menyebapkan pemisahan atau rapuh sementara untuk ikatan ion bersifat keras karena ion-ion positif dan negative terikat kuat oleh gaya elektrostatik.
NAMA: ERVIANTINA H
NPM: 2013023036
izin bertanya, bagaimana perbandingan atau perbedaan senyawa ion dan senyawa kovalen berdasarkan bisa tidaknya menghantarkan listriik?
terima kasih
NPM: 2013023036
izin bertanya, bagaimana perbandingan atau perbedaan senyawa ion dan senyawa kovalen berdasarkan bisa tidaknya menghantarkan listriik?
terima kasih
Perbedaannya jika diukur berdasarkan daya hantar listriknya yaitu pada senyawa ion padat tidak mampu menghantarkan listrik. Namun, jika senyawa tersebut leleh setelah dipanaskan, maka dalam bentuk lelehan senyawa ion dapat menghantarkan listrik. Selain itu, senyawa ini juga dapat menghantarkan listrik jika larut dalam air. Sedangkan dalam bentuk padat, ion tidak mampu bergerak bebas sehingga tidak bisa menghantarkan listrik.
Berbeda halnya dengan senyawa kovalen, senyawa kovalen tidak mampu menghantarkan listrik dalam bentuk padat maupun lelehan. Akan tetapi, beberapa senyawa kovalen ketika larut dalam air juga akan dapat menghantarkan listrik
Berbeda halnya dengan senyawa kovalen, senyawa kovalen tidak mampu menghantarkan listrik dalam bentuk padat maupun lelehan. Akan tetapi, beberapa senyawa kovalen ketika larut dalam air juga akan dapat menghantarkan listrik
Nama : Alvira Melinda
Npm : 2013023030
Izin bertanya
Kapan ikatan ionik akan terjadi? Dan bagaimana kekuatan nya saat ikatan ionik itu terjadi?
Npm : 2013023030
Izin bertanya
Kapan ikatan ionik akan terjadi? Dan bagaimana kekuatan nya saat ikatan ionik itu terjadi?
Ikatan ionik akan terjadi apabila terdapat atom yang mempunyai energi ionisasi kecil dan bertemu dengan atom yang memiliki afinitas elektron besar. Kekuatan nya saat ikatan ionik tersebut terjadi sangat bergantung pada ukuran dan muatan ion. Semakin besar ukuran ion maka ikatan ionik akan semakin lemah dan semakin tinggi muatan ion maka akan semakin kuat ikatannya.
Nama : Artika Rahmadana
NPM : 2013023026
Izin bertanya, mengapa siklus born haber didasarkan oleh hukum hess?
NPM : 2013023026
Izin bertanya, mengapa siklus born haber didasarkan oleh hukum hess?
Siklus born haber didasarkan oleh hukum Hess karena dalam pembentukan senyawa ion pada siklus born haber melibatkan kan ∆Hf = ∆HS + ∆HD + ∆HI + ∆HEA + U ; dalam hal ini
- ∆HS = entalpi atomisasi logam (atau entalpi sublimasi untuk logam yang menguap membentuk gas monoatomik)
- ∆HD = entalpi atomisasi nonlogam (atau entalpi disosiasi atau energi ikatan untuk gas nonlogam diatomik)
- ∆HI = energi ionisasi
- ∆HEA = afinitas elektron
- U = energi kisi kristal.
NAMA : ALVINA MIRANDA
NPM : 2013023016
Izin bertanya pada kelompok 10,
didalam vidio dijelaskan kristal senyawa ionik, lalu sebenarnya kristal ionik tersebut terbentuk karena apa?
terimakasih
NPM : 2013023016
Izin bertanya pada kelompok 10,
didalam vidio dijelaskan kristal senyawa ionik, lalu sebenarnya kristal ionik tersebut terbentuk karena apa?
terimakasih
Nama : Upit Nurjanah
NPM : 2013023050
izin menjawab, Kristal ionik terbentuk karena adanya ikatan ionik antara Kation dan anion. Ikatan ionik biasanya terjadi ketika perbedaan elektronegativitas antara dua atom dalam molekul diatomik lebih besar dari sekitar 2,0. Sehingga 1 atom memperoleh elektron (menjadi anion atau ion negatif), sementara atom lain dalam molekul diatomik akan kehilangan elektron (menghasilkan kation atau ion positif).
NPM : 2013023050
izin menjawab, Kristal ionik terbentuk karena adanya ikatan ionik antara Kation dan anion. Ikatan ionik biasanya terjadi ketika perbedaan elektronegativitas antara dua atom dalam molekul diatomik lebih besar dari sekitar 2,0. Sehingga 1 atom memperoleh elektron (menjadi anion atau ion negatif), sementara atom lain dalam molekul diatomik akan kehilangan elektron (menghasilkan kation atau ion positif).
Nama : Regita Gustiana Cahyani
NPM : 2013023044
Izin bertanya,
Dalam perubahan entalpi larutan (ΔHlarutan) senyawa ionik dalam pelarut air memiliki harga positif, atau pelarutan berlangsung secara endotermik sehingga suhu larutan menjadi lebih rendah. Apa penyebabnya?
NPM : 2013023044
Izin bertanya,
Dalam perubahan entalpi larutan (ΔHlarutan) senyawa ionik dalam pelarut air memiliki harga positif, atau pelarutan berlangsung secara endotermik sehingga suhu larutan menjadi lebih rendah. Apa penyebabnya?
Nama : Upit Nurjanah
NPM : 2013023050
Izin menjawab, hal ini disebabkan harga energi kisi senyawa ionik cendrung lebih besar dibandingkan harga perubahan harga entalpi solvasi (ΔHsolvasi) dari ion-ion. Energi kisi merupakan hasil interaksi ion-ion sedangkan perubahan entalpi solvasi merupakan hasil interaksi ion dipol. Harga energi kisi senyawa ionik cenderung lebih besar dibandingkan harga perubahan entalpi solvasi karena interaksi ion-ion cenderung lebih kuat dibandingkan interaksi ion dipol.
NPM : 2013023050
Izin menjawab, hal ini disebabkan harga energi kisi senyawa ionik cendrung lebih besar dibandingkan harga perubahan harga entalpi solvasi (ΔHsolvasi) dari ion-ion. Energi kisi merupakan hasil interaksi ion-ion sedangkan perubahan entalpi solvasi merupakan hasil interaksi ion dipol. Harga energi kisi senyawa ionik cenderung lebih besar dibandingkan harga perubahan entalpi solvasi karena interaksi ion-ion cenderung lebih kuat dibandingkan interaksi ion dipol.
Nama : Regita Gustiana Cahyani
NPM : 2013023044
Terimakasih upit Izin bertanya lagi, mengapa senyawa ionik akan mudah larut jika perbedaan jari-jari kation dan anionnya semakin besar?
NPM : 2013023044
Terimakasih upit Izin bertanya lagi, mengapa senyawa ionik akan mudah larut jika perbedaan jari-jari kation dan anionnya semakin besar?
Nama : Upit Nurjanah
NPM : 2013023050
Baik regita akan saya jawab pertanyaan keduanya. Hal ini dikarenakan pada pelarutan senyawa ionik dalam energi kisi menghalangi larutnya senyawa ionik sedangkan energi solvasi mendorong larutnya senyawa ionik, maka senyawa ionik akan mudah larut apabila perbedaan jari-jari kation dan anionnya makin besar. Sebaliknya, senyawa ionik makin sukar larut apabila perbedaan jari-jari kation dan anionnya makin kecil.
NPM : 2013023050
Baik regita akan saya jawab pertanyaan keduanya. Hal ini dikarenakan pada pelarutan senyawa ionik dalam energi kisi menghalangi larutnya senyawa ionik sedangkan energi solvasi mendorong larutnya senyawa ionik, maka senyawa ionik akan mudah larut apabila perbedaan jari-jari kation dan anionnya makin besar. Sebaliknya, senyawa ionik makin sukar larut apabila perbedaan jari-jari kation dan anionnya makin kecil.
Nama : Hardini Anggun
NPM : 2013023010
Kelompok : 13
Izin bertanya, berdasarkan penjelasan materi yang telah kalian sampaikan melalui video presentasi, dapatkah kalian sebutkan, kemudahan untuk terbentuknya suatu senyawa ionik itu dipengaruhi oleh apa saja?
NPM : 2013023010
Kelompok : 13
Izin bertanya, berdasarkan penjelasan materi yang telah kalian sampaikan melalui video presentasi, dapatkah kalian sebutkan, kemudahan untuk terbentuknya suatu senyawa ionik itu dipengaruhi oleh apa saja?
Kemudahan terbentuknya suatu senyawa ionik dapat dipengaruhi oleh beberapa faktor yaitu :
1. Energi ionisasi kation
2. Energi elektron anion
3. Energi kisi pada pembentukan kristal bersifat menguntungkan secara energetik, yaitu apabila :
1. Energi ionisasi kation
2. Energi elektron anion
3. Energi kisi pada pembentukan kristal bersifat menguntungkan secara energetik, yaitu apabila :
- Energi potensial (∆H) senyawa ionik yang terbentuk lebih rendah dibandingkan atom-atom pembentuknya
- Struktur yang diadopsi oleh senyawa ionik memiliki energi potensial yang paling rendah dibandingkan struktur-struktur lainnya.
Nama : Adelia Putri
NPM : 2013023014
izin bertanya
Dijelaskan oleh Muhammad Fasya bahwa senyawa ionik biasanya larut dalam pelarut polar dengan permitivitas (tetapan dielektrikum) tinggi. Apa yang menyebabkan hal tersebut terjadi?
NPM : 2013023014
izin bertanya
Dijelaskan oleh Muhammad Fasya bahwa senyawa ionik biasanya larut dalam pelarut polar dengan permitivitas (tetapan dielektrikum) tinggi. Apa yang menyebabkan hal tersebut terjadi?
Muhammad Fasya WIRANATA
NPM 2053023003
Senyawa ion dapat larut dalam larutan polar dengan konstanta dielektrikum tinggi karena menurunnya gaya antar ion dalam medium yang mempunyai dielektrik sekaligus karena terjadinya gaya tarik (interaksi) dipol antara ion dengan pelarut. Kedua hal ini memberikan energi untuk memecahkan kisi ionik. Meskipun demikian, banyak senyawa ionik larut dalam pelarut yang mempunyai konstanta dielektrik yang rendah seperti dioxan, nitrobenzen, eter, dan alkohol. Kelarutan dalam pelarut jenis ini disebabkan oleh sifat kovalen parsial dari senyawa dan terjadinya koordinasi molekul pelarut melalui atom O.
NPM 2053023003
Senyawa ion dapat larut dalam larutan polar dengan konstanta dielektrikum tinggi karena menurunnya gaya antar ion dalam medium yang mempunyai dielektrik sekaligus karena terjadinya gaya tarik (interaksi) dipol antara ion dengan pelarut. Kedua hal ini memberikan energi untuk memecahkan kisi ionik. Meskipun demikian, banyak senyawa ionik larut dalam pelarut yang mempunyai konstanta dielektrik yang rendah seperti dioxan, nitrobenzen, eter, dan alkohol. Kelarutan dalam pelarut jenis ini disebabkan oleh sifat kovalen parsial dari senyawa dan terjadinya koordinasi molekul pelarut melalui atom O.
Nama : Agus Miftahudin
Npm : 2013023046
Izin bertanya, Tadi pada vidio dijelaskan bahwa senyawa ionik pada bentuk padatan tidak dapat menghantarkan listrik tetapi pada bentuk cair dan lelehan dapat menghantarkan listrik, mengapa hal tersebut dapat terjadi?
Npm : 2013023046
Izin bertanya, Tadi pada vidio dijelaskan bahwa senyawa ionik pada bentuk padatan tidak dapat menghantarkan listrik tetapi pada bentuk cair dan lelehan dapat menghantarkan listrik, mengapa hal tersebut dapat terjadi?
Nama : Upit Nurjanah
NPM : 2013023050
Izin menjawab, senyawa ionik tidak dapat menghantarkan listrik pada bentuk padatan terjadi karena ion ionnya hanya diam didalam kisi kristal, sedangkan untuk dapat menghantarkan listrik ion ion tersebut harus bergerak. Oleh karena itulah senyawa ionik hanya menghantarkan listrik pada bentuk cair dan lelehnya. Karena pada keadaan tersebut ion ionnya dapat bergerak.
NPM : 2013023050
Izin menjawab, senyawa ionik tidak dapat menghantarkan listrik pada bentuk padatan terjadi karena ion ionnya hanya diam didalam kisi kristal, sedangkan untuk dapat menghantarkan listrik ion ion tersebut harus bergerak. Oleh karena itulah senyawa ionik hanya menghantarkan listrik pada bentuk cair dan lelehnya. Karena pada keadaan tersebut ion ionnya dapat bergerak.
Nama : Ika Diva Agustin
NPM :2013023004
Izin bertanya apakah yang dimaksud dengan energi ionisasi pada saat siklus born Haber Na menjadi Na + dan berapakah energi ionisasinya ?
NPM :2013023004
Izin bertanya apakah yang dimaksud dengan energi ionisasi pada saat siklus born Haber Na menjadi Na + dan berapakah energi ionisasinya ?
Muhammad Fasya Wiranata
npm 2053023003
Energi ionisasi adalah energi yang diperlukan oleh suatu atom dalam bentuk gas untuk melepas satu elektron membentuk ion positif. pada siklus born habber Na disitu berwujud Gas dan melepaskan satu elektron sehingga menjadi Na+ dan membutuhkan energi yang disebut energi ionisasi, energi ionisasi pada Na yang menjadi Na+ pada siklus born habber seharga 496 KJ
npm 2053023003
Energi ionisasi adalah energi yang diperlukan oleh suatu atom dalam bentuk gas untuk melepas satu elektron membentuk ion positif. pada siklus born habber Na disitu berwujud Gas dan melepaskan satu elektron sehingga menjadi Na+ dan membutuhkan energi yang disebut energi ionisasi, energi ionisasi pada Na yang menjadi Na+ pada siklus born habber seharga 496 KJ
Nama : Mulyawan Saputra
NPM : 2013023038
izin bertanya, Pada senyawa NaCl Mengapa Na sebagai kation dan Cl sebagai anion?
NPM : 2013023038
izin bertanya, Pada senyawa NaCl Mengapa Na sebagai kation dan Cl sebagai anion?
Atom yang menerima elektron memiliki muatan listrik negatif dan disebut dengan anion. sedangkan atom yang melepaskan elektron memiliki muatan listrik positif dan disebut dengan kation.
Atom Natrium memiliki elektron valensi 1 dan atom Klor memiliki elektron valensi 7. Menurut aturan duplet dan oktet, atom cenderung stabil jika elektron valensinya adalah 2 atau 8. Disini kita menggunakan aturan oktet dimana elektron valensi Na dan Cl harus dibuat menjadi 8.
Untuk mencapai aturan oktet maka, Na akan melepaskan 1 elektron sedangkan Cl akan menerima 1 elektron. Sehingga Na akan menjadi kation dan Cl menjadi anion.
Atom Natrium memiliki elektron valensi 1 dan atom Klor memiliki elektron valensi 7. Menurut aturan duplet dan oktet, atom cenderung stabil jika elektron valensinya adalah 2 atau 8. Disini kita menggunakan aturan oktet dimana elektron valensi Na dan Cl harus dibuat menjadi 8.
Untuk mencapai aturan oktet maka, Na akan melepaskan 1 elektron sedangkan Cl akan menerima 1 elektron. Sehingga Na akan menjadi kation dan Cl menjadi anion.
Nama : Ayu Febrina Mutiara Ad'ha
Npm : 2013023062
Izin bertanya, apakah Fermitivitas hampa itu?
Npm : 2013023062
Izin bertanya, apakah Fermitivitas hampa itu?
Nama : Upit Nurjanah
NPM : 2013023050
Izin menjawab, permitivitas ruang hampa (Permitivitas vakum), adalah kemampuan vakum untuk bisa dilewati garis medan listrik. Konstanta ini menghubungkan konstanta fisika ideal yang merupakan nilai permitivitas dielektrik absolut vakum klasik.
NPM : 2013023050
Izin menjawab, permitivitas ruang hampa (Permitivitas vakum), adalah kemampuan vakum untuk bisa dilewati garis medan listrik. Konstanta ini menghubungkan konstanta fisika ideal yang merupakan nilai permitivitas dielektrik absolut vakum klasik.
Nama : Rizka Awalia Rodhiah
Npm : 2013023060
Izin bertanya
Mengapa jumlah elektron terluar dari dua atom berikatan akan berubah sedemikian rupa sehingga kedua elektron dari kedua atom tersebut sama dengan susunan gas mulia?
Npm : 2013023060
Izin bertanya
Mengapa jumlah elektron terluar dari dua atom berikatan akan berubah sedemikian rupa sehingga kedua elektron dari kedua atom tersebut sama dengan susunan gas mulia?
Nama : Upit Nurjanah
NPM : 2013023050
izin menjawab, karena kecenderungan atom-atom untuk memiliki konfigurasi elektron seperti gas mulia disebut kaidah oktet dan kaidah duplet. Kaidah oktet dipenuhi apabila atom memiliki 8 elektron pada kulit terluar sedangkan kaidah duplet dipenuhi apabila atom memiliki 2 elektron pada kulit terluar. Untuk atom-atom yang mempunyai nomor atom kecil dari hidrogen sampai dengan boron cenderung memiliki konfigurasi elektron seperti gas helium atau mengikuti kaidah Duplet, selebihnya mengikuti kaidah oktet.
NPM : 2013023050
izin menjawab, karena kecenderungan atom-atom untuk memiliki konfigurasi elektron seperti gas mulia disebut kaidah oktet dan kaidah duplet. Kaidah oktet dipenuhi apabila atom memiliki 8 elektron pada kulit terluar sedangkan kaidah duplet dipenuhi apabila atom memiliki 2 elektron pada kulit terluar. Untuk atom-atom yang mempunyai nomor atom kecil dari hidrogen sampai dengan boron cenderung memiliki konfigurasi elektron seperti gas helium atau mengikuti kaidah Duplet, selebihnya mengikuti kaidah oktet.
Nama : Elisabet Erlian Nadia Putri
NPM : 2013023042
Izin bertanya, Pada video dijelaskan bahwa senyawa ionik biasanya larut dalam pelarut polar, apa yang menyebabkan senyawa ionik tidak dapat larut dalam pelarut non polar?
NPM : 2013023042
Izin bertanya, Pada video dijelaskan bahwa senyawa ionik biasanya larut dalam pelarut polar, apa yang menyebabkan senyawa ionik tidak dapat larut dalam pelarut non polar?
In reply to Elisabet Erlian Nadia Putri 2013023042
Re: Padatan ionik
Muhammad Fasya Wiranata
npm 2053023003
Padatan ionik ini tidak larut dalam pelarut non-polar (seperti CCl4, benzena, dan heksana). Karena molekul non-polar disatukan oleh gaya antarmolekul van der Waals yang lemah, sementara tarikan ion-ion (dalam padatan ionik) jauh lebih kuat daripada gaya daya tarik ion-pelarut. Oleh karena itu, molekul pelarut non-polar tidak dapat menembus kisi ionik dan karenanya pelarut non-polar ini tidak dapat melarutkan padatan ionik.
npm 2053023003
Padatan ionik ini tidak larut dalam pelarut non-polar (seperti CCl4, benzena, dan heksana). Karena molekul non-polar disatukan oleh gaya antarmolekul van der Waals yang lemah, sementara tarikan ion-ion (dalam padatan ionik) jauh lebih kuat daripada gaya daya tarik ion-pelarut. Oleh karena itu, molekul pelarut non-polar tidak dapat menembus kisi ionik dan karenanya pelarut non-polar ini tidak dapat melarutkan padatan ionik.
Nama : Sindi Amilia
NPM : 2013023048
izin bertanya, Kestabilan senyawa ionik disebabkan oleh apa? Dan energi kisi dari suatu senyawa ionik dapat ditentukan dengan apa?
NPM : 2013023048
izin bertanya, Kestabilan senyawa ionik disebabkan oleh apa? Dan energi kisi dari suatu senyawa ionik dapat ditentukan dengan apa?
Muhammad Fasya Wiranata
npm 2053023003
izin menjawab
Kestabilan senyawa ionik diperoleh apabila energi kisi dapat mengatasi energi energi yang diperlukan pada beberapa tahap endotermik dalam pembentukan senyawa ionik dari unsur-unsurnya. Kestabilan senyawa ionik bukan disebabkan oleh dipenuhinya aturan oktet oleh kation-kation penyusunnya dan energi kisi dari suatu senyawa ionik dapat ditentukan secara eksperimental maupun dengan perhitungan dalam metode perhitungan apabila struktur kristal senyawa ionik dan jarak antara kation dan anion telah diketahui maka energi kisi kristal dapat dihitung dengan persamaan born-lande. Sedangkan secara eksperimental energi kisi kristal ditentukan dengan menggunakan daur born haber
npm 2053023003
izin menjawab
Kestabilan senyawa ionik diperoleh apabila energi kisi dapat mengatasi energi energi yang diperlukan pada beberapa tahap endotermik dalam pembentukan senyawa ionik dari unsur-unsurnya. Kestabilan senyawa ionik bukan disebabkan oleh dipenuhinya aturan oktet oleh kation-kation penyusunnya dan energi kisi dari suatu senyawa ionik dapat ditentukan secara eksperimental maupun dengan perhitungan dalam metode perhitungan apabila struktur kristal senyawa ionik dan jarak antara kation dan anion telah diketahui maka energi kisi kristal dapat dihitung dengan persamaan born-lande. Sedangkan secara eksperimental energi kisi kristal ditentukan dengan menggunakan daur born haber
Izin bertanya,
Nama: Apriza Yanti
NPM: 2013023064
Mengapa senyawa ionik memiliki titik leleh yang tinggi?
Nama: Apriza Yanti
NPM: 2013023064
Mengapa senyawa ionik memiliki titik leleh yang tinggi?
Nama : Upit Nurjanah
NPM : 2013023050
Izin menjawab, hal ini dikarenakan ikatan yang terjadi antara ion positif (kation) dengan ion negatif (anion) pada senyawa ion sangat kuat sehingga untuk memisahkan ion-ion memerlukan energi yang besar.
NPM : 2013023050
Izin menjawab, hal ini dikarenakan ikatan yang terjadi antara ion positif (kation) dengan ion negatif (anion) pada senyawa ion sangat kuat sehingga untuk memisahkan ion-ion memerlukan energi yang besar.
Nama : Annisa Sholeha
NPM : 2013023032
izin bertanya, di dalam video telah dijelaskan bahwa senyawa ionik sangat keras tetapi rapuh, sekalipun pemisahannya secara mekanik ketimbangan pemisahan termal terhadap gaya tarik-menarik antar ion. Pertanyaan saya adalah bagaimana pemisahan secara mekanik dan termal itu?
NPM : 2013023032
izin bertanya, di dalam video telah dijelaskan bahwa senyawa ionik sangat keras tetapi rapuh, sekalipun pemisahannya secara mekanik ketimbangan pemisahan termal terhadap gaya tarik-menarik antar ion. Pertanyaan saya adalah bagaimana pemisahan secara mekanik dan termal itu?
Terdapat 2 macam metode umum pemisahan bahan yaitu pemisahan dengan cara mekanis dan pemisahan bahan dengan cara kontak keseimbangan bahan. Perbedaan keduanya adalah pada ada tidaknya perubahan fasa bahan setelah dipisahkan. Pemisahan dengan metode mekanis merupakan pemisahan bahan dengan tetap mempertahankan fasa bahan atau tidak mengalami perubahan fasa bahan, sedangkan pemisahan bahan dengan kontak keseimbangan bahan dapat mengubah fasa bahan yang dipisahkan dari fasa awalnya. Pemisahan mekanis ini contonya adalah pengendapan, filtrasi, ekstraksi, dan sentrifugasi.
Pemisahan termal adalah metode pemisahan dengan melakukan pemanasan. Temperatur dalam melakukan pemanasan harus berada diantara titik didih zat-zat penyusunnya.
Pemisahan termal adalah metode pemisahan dengan melakukan pemanasan. Temperatur dalam melakukan pemanasan harus berada diantara titik didih zat-zat penyusunnya.
